在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g)
M(g)+N(g)
所得实验数据如下表:
实验编号
|
温度/℃
|
起始时物质的量/mol
|
平衡时物质的量/mol
|
n(X)
|
n(Y)
|
n(M)
|
①
|
700
|
0.40
|
0.10
|
0.090
|
②
|
800
|
0.10
|
0.40
|
0.080
|
③
|
800
|
0.20
|
0.30
|
a
|
④
|
900
|
0.10
|
0.15
|
b
|
回答下列问题:
(1)实验①中,若5min时测得,n(M)=0.050mo1, 则0至5min时间内,用N表示的平均反应速率为_ 。
(2)实验③平衡常数为___________,该正反应为____________反应(填“吸热”或“放热”)
(3)能说明上述反应一定达到平衡的条件是_______________________。
A.c(Y)= c(N) B.平均分子量不再变化
C.v正(X) =v逆(M) D.温度和压强一定时,混合气体的密度不再变化
(4)实验③中,达到平衡时,X的转化率为_____________________。
(5)实验③、④中,达到平衡时,a与b的关系为__________(填选项),请解释原因________________。
A.a>2b B.a=2b C.b<a<2b D.a<b
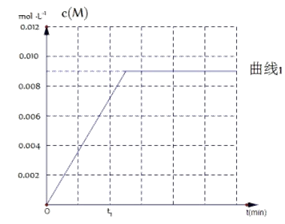
(6)图是实验①中c(M)随时间变化的曲线图,请在图中画出实验②中c(M)随时间变化的曲线图。