实验室以含有、、、、等离子的卤水为主要原料制备无水和,流程如下:

(1)操作Ⅰ使用的试剂是,所用主要仪器的名称是。
(2)加入溶液W的目的是。用调节溶液Y的,可以除去。由表中数据可知,理论上可选择最大范围是。酸化溶液Z时,使用的试剂为。

(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是。
| A. |
a. |
| B. |
b. |
| C. |
c. |
| D. |
d. |
(4)常温下,的电离常数,,的电 离常数,。某同学设计实验验证酸性强于:将和气体分别通入水中至饱和,立即用酸度计测两溶液的,若前者的小于后者,则酸性强于。该实验设计不正确,错误在于。
离常数,。某同学设计实验验证酸性强于:将和气体分别通入水中至饱和,立即用酸度计测两溶液的,若前者的小于后者,则酸性强于。该实验设计不正确,错误在于。
设计合理实验验证酸性强于(简要说明实验步骤、现象和结论)。。仪器器自选。
供选的试剂:、、、、、、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、试纸。





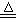 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O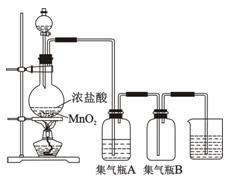
 方程式。
方程式。 列问题。
列问题。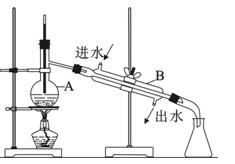

 外,为防止液体暴沸还需加入少量。
外,为防止液体暴沸还需加入少量。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号