黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成 分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究.
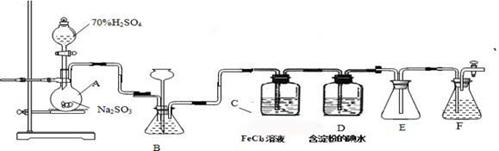
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2→2 Fe2O3+8SO2(高温)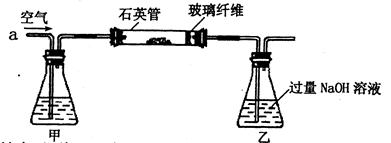
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: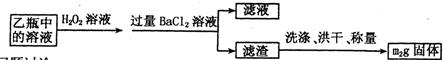
问题讨论:
(1)1中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有
、 。
(2)Ⅱ中,所加H2O2溶液需足量的理由是 。
(3)该黄铁矿石中硫元素的质量分数为 。
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫: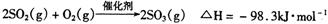 在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2
在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2 的转化率为 。
的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的 。
②工业生产中常用氨一酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用化学方程式表示其反应原理。(只写出2个方程式即可)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号