苹果酸是一种常见的有机酸,其结构简式为: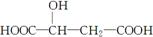
(1)苹果酸分子所含官能团的名称是______、________。
(2)苹果酸不可能发生的反应有________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应
④氧化反应 ⑤消去反应 ⑥取代反应
(3)物质A(C4H5O4Br)在一定条件下可发生水解反应,得到苹果酸和溴化氢。由A制取
苹果酸的化学方程式是____________________________________________________。
苹果酸是一种常见的有机酸,其结构简式为: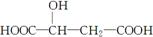
(1)苹果酸分子所含官能团的名称是______、________。
(2)苹果酸不可能发生的反应有________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应
④氧化反应 ⑤消去反应 ⑥取代反应
(3)物质A(C4H5O4Br)在一定条件下可发生水解反应,得到苹果酸和溴化氢。由A制取
苹果酸的化学方程式是____________________________________________________。