在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应: 达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
A.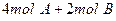 |
B.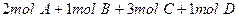 |
C.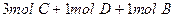 |
D.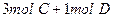 |
在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应: 达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是
A.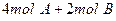 |
B.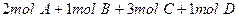 |
C.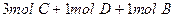 |
D.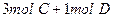 |