在一定温度下,下列叙述不是可逆反应A(g)+3B(g)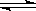 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;(2)单位时间内amol A生成,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amol A,同时生成3amol B;(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5) B. (2)(7) C.(1)(3) D.(5)(6)
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)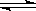 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;(2)单位时间内amol A生成,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amol A,同时生成3amol B;(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5) B. (2)(7) C.(1)(3) D.(5)(6)