下列有机化合物中,有多个官能团: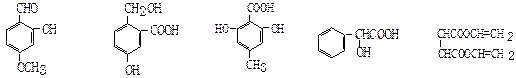
| A. | B. | C. | D.E. |
⑴可以看作醇类的是(填入编号,下同):______ _______;
⑵可以看作酚类的是___ _____;
⑶可以看作羧酸类的是__________________;
⑷可以看作酯类的是_________ ___。
下列有机化合物中,有多个官能团: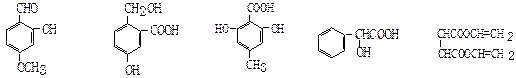
| A. | B. | C. | D.E. |
⑴可以看作醇类的是(填入编号,下同):______ _______;
⑵可以看作酚类的是___ _____;
⑶可以看作羧酸类的是__________________;
⑷可以看作酯类的是_________ ___。