已知2X2(g)+Y2(g) 2Z(g),△H=-a kJ•mol-1(a>0),在一个容积固定的容器中加入2molX2和1molY2,在500℃时充分反应达平衡后Z的浓度为W mol•L-1,放出热量b kJ。
2Z(g),△H=-a kJ•mol-1(a>0),在一个容积固定的容器中加入2molX2和1molY2,在500℃时充分反应达平衡后Z的浓度为W mol•L-1,放出热量b kJ。
(1)此反应平衡常数表达式为 ▲ ;若将温度降低到300℃,则反应平衡常数将 ▲ (填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度
▲ Wmol•L-1(填“>”、“<”或“=”),a、b、c之间满足关系 ▲ (用代数式表示)。
(3)能说明反应已达平衡状态的是 ▲ 。
| A.浓度c(Z)=2c(Y2) | B.容器内压强保持不变 |
| C.v逆(X2)=2v正(Y2) | D.容器内的密度保持不变 |
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将 ▲ (填“变大”、“变小”或“不变”)。
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题: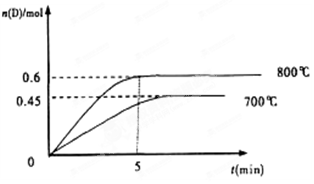
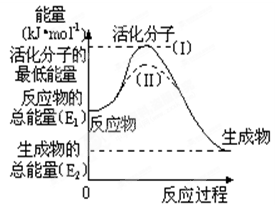
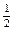 O2(g) =H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为。
O2(g) =H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则逆反应的活化能为。 Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是。
Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是。
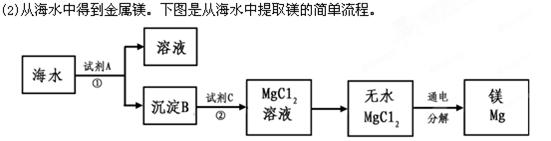 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________, 粤公网安备 44130202000953号
粤公网安备 44130202000953号