有机物A的结构简式为 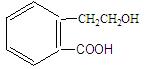 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。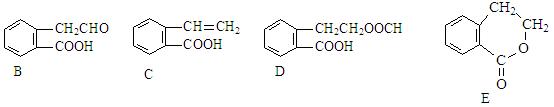
请回答下列问题:
(1)在A-E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成B的化学方程式和反应类型 ,反应类型: 。
(3)C能形成高聚物,该高聚物的结构简式为 。
(4)写出D与NaOH溶液共热反应的化学方程式 。
有机物A的结构简式为  ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)在A-E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成B的化学方程式和反应类型 ,反应类型: 。
(3)C能形成高聚物,该高聚物的结构简式为 。
(4)写出D与NaOH溶液共热反应的化学方程式 。