某有机化合物结构如下,分析其结构并完成下列问题: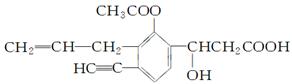
(1)写出其分子式__________。
(2)写出含氧官能团的名称________________________________。
(3)其中含有__ ___个不饱和碳原子,分子中有_______
___个不饱和碳原子,分子中有_______ _种双键,有___
_种双键,有___ _________个手性碳原子。
_________个手性碳原子。
(4)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。
某有机化合物结构如下,分析其结构并完成下列问题:
(1)写出其分子式__________。
(2)写出含氧官能团的名称________________________________。
(3)其中含有__ ___个不饱和碳原子,分子中有_______
___个不饱和碳原子,分子中有_______ _种双键,有___
_种双键,有___ _________个手性碳原子。
_________个手性碳原子。
(4)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。