下表列出了①~⑥六种元素在元素周期表中的位置。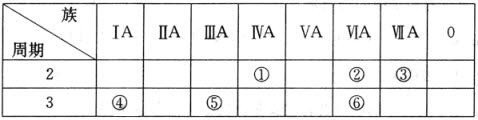 [
[
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是____(填写元素符号);
(2)元素⑥的气态氢化物的分子式是____;
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是____________________________。
下表列出了①~⑥六种元素在元素周期表中的位置。 [
[
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是____(填写元素符号);
(2)元素⑥的气态氢化物的分子式是____;
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是____________________________。