常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA |
NaOH |
混合溶液的pH |
| 甲 |
[HA]=0.2 mol·L-1 |
[NaOH]="0.2" mol·L-1 |
pH=a |
| 乙 |
[HA]=c1 mol·L-1 |
[NaOH]="0.2" mol·L-1 |
pH=7 |
| 丙 |
[HA]="0.1" mol·L-1 |
[NaOH]="0.1" mol·L-1 |
pH=9 |
| 丁 |
pH=2 |
pH=12 |
pH=b |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?
(2)c1 (填“<”、“>”或“=”)0.2 mol·L-1。乙组实验中HA和NaOH溶液混合前,HA溶液中[A-]与NaOH溶液中[Na+]的关系是 (从下面选项中选择填空)
| A.前者大 | B.后者大 | C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ,其中,[A-]= mol·L-1(不能做近似计算,回答准确值,结果不一定要化简)。
(4)丁组实验中,HA和NaOH溶液混合前[HA] (填“<”、“>”或“=”)[NaOH], b 7(填“<”、“>”或“=”)

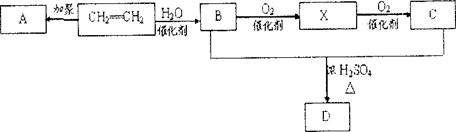
 B的反应类型(选填取代反应或加成反应) 。
B的反应类型(选填取代反应或加成反应) 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号