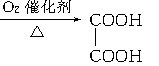
有以下一系列反应,终产物为草酸,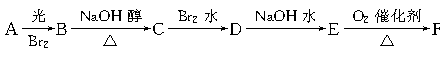
已知B的相对分子质量比A的大79
(1)写出下列步骤的反应类型
A→B:___________ B→C:___________ C→D:___________
(2)写出下列步骤反应的化学方程式
C→D:__________________________________________
E→F:__________________________________________
有以下一系列反应,终产物为草酸,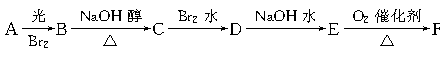

已知B的相对分子质量比A的大79
(1)写出下列步骤的反应类型
A→B:___________ B→C:___________ C→D:___________
(2)写出下列步骤反应的化学方程式
C→D:__________________________________________
E→F:__________________________________________