有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示: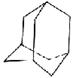
(1)由图可知其分子式为:____________,一氯代物有_______种。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。
有的油田开采的石油中溶有一种碳氢化合物——金刚烷,它的分子立体结构如图所示:
(1)由图可知其分子式为:____________,一氯代物有_______种。
(2)它是由_________ 个六元环构成的六体的笼状结构,其中有__________个碳原子为三个环共有。