磷肥生产中形成的副产物石膏(CaSO4·2H2O可以转化为硫酸钾肥料和氯化钙水合物储热材料。以下是转化的工艺流程示意图)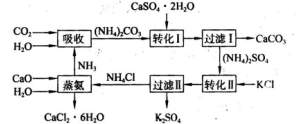
(1)本工艺中所用的原料除CsSO4·2H2O、KCl、H2O和NH3外,还需要 等原料。
(2)本工艺中,提高吸收CO2能力的方法是 。
(3)工业上用铁做催化剂合成原料气NH3时,常控制温度在700K左右,原因是 。
(4)上述工艺流程中体现绿色化学理念的是 (写出三条即可)
磷肥生产中形成的副产物石膏(CaSO4·2H2O可以转化为硫酸钾肥料和氯化钙水合物储热材料。以下是转化的工艺流程示意图)
(1)本工艺中所用的原料除CsSO4·2H2O、KCl、H2O和NH3外,还需要 等原料。
(2)本工艺中,提高吸收CO2能力的方法是 。
(3)工业上用铁做催化剂合成原料气NH3时,常控制温度在700K左右,原因是 。
(4)上述工艺流程中体现绿色化学理念的是 (写出三条即可)