ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: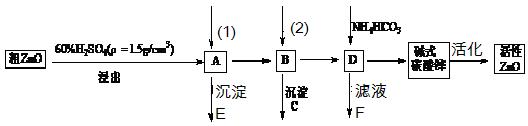
已知此溶液中Fe2+、 Fe3+、 Cu2+ 、 Zn2+形成氢氧化物的pH如下表
| 离子 |
开始沉沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.5 |
| Zn2+ |
6.8 |
9 |
(1)已知H2O2酸性溶液中能氧化Fe2+,反应的离子方程式为
(2)题目中框图中的(1)和(2)是需要加入的试剂依次是_______、_______。(用序号回答)
①ZnO ②H2O2较浓溶液 ③Na2CO3溶液
(3)加入试剂(2)应将杂质离子完全转化成沉淀C, 溶液的pH应控制在 ;
要实现该步骤中pH的控制,应使用 来检查溶液的pH
(4)书写碱式碳酸锌焙烧制备活性ZnO的化学方程式 .
(5)重晶石(主要成分BaSO4)是制备钡的化合物的重要原料,但BaSO4不溶于酸,工业上常常将其转化为BaCO3,再进一步制备其他钡的化合物。已知Ksp(BaSO4) = 1.0×10-10,Ksp(BaCO3) = 2×10-9。计算将BaSO4(s)转化为BaCO3(s)所需C(CO32-)应 mol/L
 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

 粤公网安备 44130202000953号
粤公网安备 44130202000953号