下表是元素周期表的一部分,回答下列有关问题:(8分)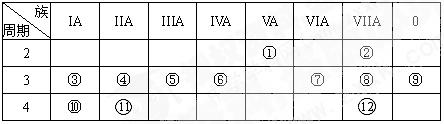
(1)写出下列元素符号:① ________⑥ ________⑦ ________。
(2)画出⑧的原子的结构示意图:_____________
(3)③、④、⑤的原子半径由大到小顺序排列为____________(用元素符号表示)
(4)最不活泼的元素是_______(填元素名称),呈两性的氢氧化物是________。(填化学式)
(5)⑩在元素周期表中的位置为_____________________
下表是元素周期表的一部分,回答下列有关问题:(8分)
(1)写出下列元素符号:① ________⑥ ________⑦ ________。
(2)画出⑧的原子的结构示意图:_____________
(3)③、④、⑤的原子半径由大到小顺序排列为____________(用元素符号表示)
(4)最不活泼的元素是_______(填元素名称),呈两性的氢氧化物是________。(填化学式)
(5)⑩在元素周期表中的位置为_____________________