(3分)根据氯化铵和硫酸钠的溶解度曲线(如图),回答下列问题: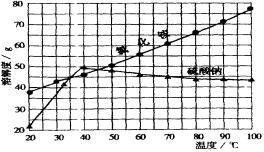
(1)50℃时,氯化铵的溶解度约为 。
(2)将40℃时上述两种物质的饱和溶液分别升温至45℃,所得氯化铵溶液的溶质质量分数 (填“>”、“<”或“=”)硫酸钠的溶质质量分数。
(3)60℃时,将氯化铵和硫酸钠各35g分别溶于100g水中形成溶液,冷却到20℃时,有晶体析出的是 。
(3分)根据氯化铵和硫酸钠的溶解度曲线(如图),回答下列问题:
(1)50℃时,氯化铵的溶解度约为 。
(2)将40℃时上述两种物质的饱和溶液分别升温至45℃,所得氯化铵溶液的溶质质量分数 (填“>”、“<”或“=”)硫酸钠的溶质质量分数。
(3)60℃时,将氯化铵和硫酸钠各35g分别溶于100g水中形成溶液,冷却到20℃时,有晶体析出的是 。