下表为KCl在不同温度下的溶解度: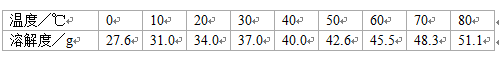
(1) 由上表可推测KCl溶解度随温度的升高而___________(填“增大”或“减小”)。
(2) 在10℃时,向100 g水中加入40g KCl固体,充分混合后所得溶液为________(填“饱和”或“不饱和”)溶液;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为___________(计算结果精确到0.1%)。
(3) 将60℃时145.5gKCl的饱和溶液降温到40℃,析出晶体的质量是 _________ g。
下表为KCl在不同温度下的溶解度:
(1) 由上表可推测KCl溶解度随温度的升高而___________(填“增大”或“减小”)。
(2) 在10℃时,向100 g水中加入40g KCl固体,充分混合后所得溶液为________(填“饱和”或“不饱和”)溶液;将其温度升高到50℃时,若不考虑溶剂的变化,则该溶液中溶质的质量分数为___________(计算结果精确到0.1%)。
(3) 将60℃时145.5gKCl的饱和溶液降温到40℃,析出晶体的质量是 _________ g。