(5分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水 平②2CH3CHO+O2
平②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路
2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路 线如下图所示。
线如下图所示。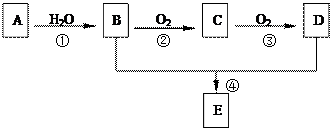
回答下列问题:
(1)B、E分子中的官能团名称分别是 、 。
(2)写出下列反应的反应类型:④ 。
(3)写出反应②的化学方程式: 。
(5分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水 平②2CH3CHO+O2
平②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路
2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路 线如下图所示。
线如下图所示。
回答下列问题:
(1)B、E分子中的官能团名称分别是 、 。
(2)写出下列反应的反应类型:④ 。
(3)写出反应②的化学方程式: 。