(1)带有2个单位正电荷的微粒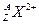 ,质量数A是137,中子数N
,质量数A是137,中子数N
是81,2.74g该微粒所含有的电子约为 mol。
(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25% 。
①计算R的相对原子质量为 ;
②写出R最高价氧化物对应的水化物的化学式 .
(1)带有2个单位正电荷的微粒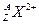 ,质量数A是137,中子数N
,质量数A是137,中子数N
是81,2.74g该微粒所含有的电子约为 mol。
(2)某元素最高价氧化物的化学式是RO2,已知其气态氢化物中含氢25% 。
①计算R的相对原子质量为 ;
②写出R最高价氧化物对应的水化物的化学式 .