工业上常用铁质容器盛装冷浓硫酸。某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:
称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
(2)取320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过____________ 、______________(填操作名称)、干燥后,得到固体2.33 g。气体N与溴水反应的化学方程式为_______________,计算推知气体N中SO2的体积分数为_______________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是_____________,理由是________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是_____________(填字母),其中A的作用是_____________,B中试剂X的化学式是_____________________。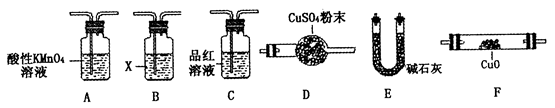


 粤公网安备 44130202000953号
粤公网安备 44130202000953号