室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在适合的反应条件下,它们可以按照下面框图进行反应。又知E是无色溶液,请回答: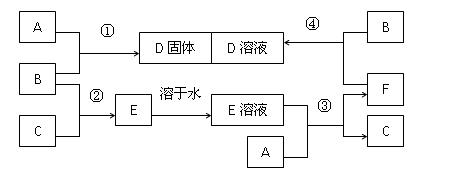
(1)B溶于水的离子方程式  。
。
(2)反应④的离子方程式为 。
(3)向F的溶液中加入烧碱溶液后在空气中静置,可观察到的现象有 。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在适合的反应条件下,它们可以按照下面框图进行反应。又知E是无色溶液,请回答:
(1)B溶于水的离子方程式  。
。
(2)反应④的离子方程式为 。
(3)向F的溶液中加入烧碱溶液后在空气中静置,可观察到的现象有 。