(10分)中国古代四大发明之一——黑火药,它的爆炸反应为
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 A的电子式为
③。原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,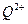 的未成对电子数是 。
的未成对电子数是 。
(10分)中国古代四大发明之一——黑火药,它的爆炸反应为
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 A的电子式为
③。原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,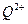 的未成对电子数是 。
的未成对电子数是 。