(1)有下列各组物质:
| A.O2和O3 | B.12C和13C | C.CH3CH2CH2CH3和CH3CH(CH3)CH3 | D.CH3CH2CH2CH==CH2和CH2==CHCH2CH2CH3 E.甲烷和辛烷 |
(1)互为同位素的是______________;(2)互为同素异形体的是______________;
(3)互为同系物的是______________;(4)是同一种物质的是 ______________ 。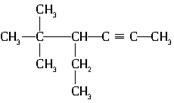 的系统名称为_________________。
的系统名称为_________________。
(1)有下列各组物质:
| A.O2和O3 | B.12C和13C | C.CH3CH2CH2CH3和CH3CH(CH3)CH3 | D.CH3CH2CH2CH==CH2和CH2==CHCH2CH2CH3 E.甲烷和辛烷 |
(1)互为同位素的是______________;(2)互为同素异形体的是______________;
(3)互为同系物的是______________;(4)是同一种物质的是 ______________ 。 的系统名称为_________________。
的系统名称为_________________。