某非金属单质A经如下图所示的过程转化为含 氧酸D,已知D为强酸,请回答下列问题:
氧酸D,已知D为强酸,请回答下列问题: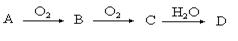
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①A的化学式:
②工业生产中大量排放的B气体被雨水吸收后形成 而污染环境。
③写出B→C反应的化学方程式:
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是:A ,C
②写出B→C反应的化学方程式:
某非金属单质A经如下图所示的过程转化为含 氧酸D,已知D为强酸,请回答下列问题:
氧酸D,已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①A的化学式:
②工业生产中大量排放的B气体被雨水吸收后形成 而污染环境。
③写出B→C反应的化学方程式:
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是:A ,C
②写出B→C反应的化学方程式: