(4分)已知:CH2=CH-CH=CH2和Br2按物质的量之比1:1发生加成反应时,可得到两种产物:CH2BrCHBrCH=CH2与CH2BrCH=CHCH2Br,
则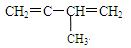
①和Br2 按物质的量之比1:1发生加成反应时,可得到 种产物
②和HBr按物质的量之比1:1发生加成反应时,可得到 种产物。
(4分)已知:CH2=CH-CH=CH2和Br2按物质的量之比1:1发生加成反应时,可得到两种产物:CH2BrCHBrCH=CH2与CH2BrCH=CHCH2Br,
则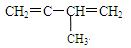
①和Br2 按物质的量之比1:1发生加成反应时,可得到 种产物
②和HBr按物质的量之比1:1发生加成反应时,可得到 种产物。