氮及其化合物与人们的生活息息相关。
(1)实验室可用铜与稀硝酸反应制取NO,其离子方程式是。为防止环境污染,可用碱液吸溶液完全吸收后得到一种钠盐收氮的氧化物。N O与NO2按物质的量之比1:1被NaOH,该化学方程式是。
O与NO2按物质的量之比1:1被NaOH,该化学方程式是。
(2)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g)△H=" -574" kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g)△H=" -1160" kJ·mol-1
根据①和②,标准状况下的4.48 L CH4恰好将NO2转化为N2时,△H=。
(3)同温同压下,3.5 L NH3恰好将3.0 LNO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是 。
(4)向含有1mol HNO3的稀硝酸中逐渐加入铁粉,所得氧化产物a、b与铁粉物质的量关系如图所示。n3 =p= 。
 ______________________
______________________ ______________________
______________________ ______________________
______________________ ______________________
______________________ ______________________
______________________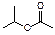 ______________________
______________________