某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下: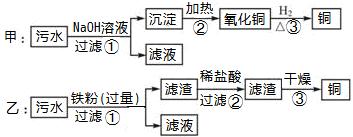
(1)以上实验方案能否得到铜(填“能”或“不能”):甲_______,乙________。
(2)在可制得铜的方案中,写出所有反应的离子方程式_______________________。
某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+四种离子,甲、乙、丙三位同学设计从污水中回收铜的方案如下:
(1)以上实验方案能否得到铜(填“能”或“不能”):甲_______,乙________。
(2)在可制得铜的方案中,写出所有反应的离子方程式_______________________。