科学探究的基本程序包括形成问题、建立假设、设计研究方案、检验假设、表达或交流结果等。请根据课本中的《活动与探究》相关知识回答问题。
某同学应用如下所示装置研究气体的性质。现有某气体,其 主要成分是氯气,还含有少量空气和水蒸气。
主要成分是氯气,还含有少量空气和水蒸气。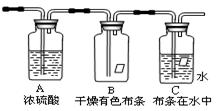
请回答:该项研究的主要目的是__ _。浓硫酸的作用是_ __。B、C中能观察到的实验现象是_ 。从物质性质方面来看,这样的实验设计方案不符合绿色化学的理念,你认为该如何改进?__ ___。
科学探究的基本程序包括形成问题、建立假设、设计研究方案、检验假设、表达或交流结果等。请根据课本中的《活动与探究》相关知识回答问题。
某同学应用如下所示装置研究气体的性质。现有某气体,其 主要成分是氯气,还含有少量空气和水蒸气。
主要成分是氯气,还含有少量空气和水蒸气。
请回答:该项研究的主要目的是__ _。浓硫酸的作用是_ __。B、C中能观察到的实验现象是_ 。从物质性质方面来看,这样的实验设计方案不符合绿色化学的理念,你认为该如何改进?__ ___。