已知: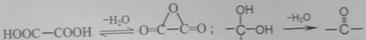
由苯酚等原料合成酚酞的流程如下(其它试剂、产物及反应条件均省略):
请回答:
(1)酚酞中含氧官能团的名称是_______________。
(2)1molM物质完全燃烧需消耗_____molO2;1molN最多可与____molNaOH反应。
(3)写出E→F化学方程式:____________________。
(4)D的结构简式为________;E与G形成高分子化合物的结构简式为_______。
已知:
由苯酚等原料合成酚酞的流程如下(其它试剂、产物及反应条件均省略):
请回答:
(1)酚酞中含氧官能团的名称是_______________。
(2)1molM物质完全燃烧需消耗_____molO2;1molN最多可与____molNaOH反应。
(3)写出E→F化学方程式:____________________。
(4)D的结构简式为________;E与G形成高分子化合物的结构简式为_______。