某药物中间体合成路线如下(部分反应条件和产物略)
(1)写出下列物质的结构简式:A ,D 。
(2)反应①、②的目的是 。
(3)写出满足下列条件的A的一种同分异构体的结构简式 。
a.不溶于水 b.能发生银镜反应 c.含有一C(CH3)3
(4)写出B→C反应的化学方程式为 。
(5)  是B的一种重要的同分异构体。请设计合理方案,完成从
是B的一种重要的同分异构体。请设计合理方案,完成从 到
到 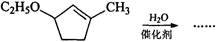 的合成路线(用流程图表示,并注明反应条件)。
的合成路线(用流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选:
②合成路线流程图示例如下:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号