氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强
C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是 。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率 ,该温度下,反应的平衡常数K= 。
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |
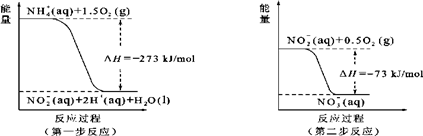




 在一定温度下,
在一定温度下, 6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号