下图表示常见物质的相互转化关系(图中反应条件及部分反应物或生成物略去)。X是黄绿色气体;M、N为金属单质,其中M是地壳中含量最多的金属元素;E为红褐色固体;反应③常用于冶炼金属。试回答下列问题: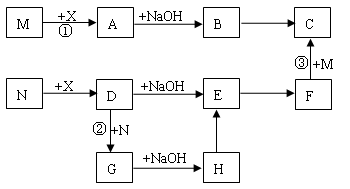
(1)物质E的化学式为 ▲ 。
( 2)画出X的组成元素原子结构简图 ▲ 。
2)画出X的组成元素原子结构简图 ▲ 。
(3)写出反应②的离子方程式 ▲ 。
(4)分别写出反应①、③的化学方程式 ▲ 、 ▲ 。
下图表示常见物质的相互转化关系(图中反应条件及部分反应物或生成物略去)。X是黄绿色气体;M、N为金属单质,其中M是地壳中含量最多的金属元素;E为红褐色固体;反应③常用于冶炼金属。试回答下列问题:
(1)物质E的化学式为 ▲ 。
( 2)画出X的组成元素原子结构简图 ▲ 。
2)画出X的组成元素原子结构简图 ▲ 。
(3)写出反应②的离子方程式 ▲ 。
(4)分别写出反应①、③的化学方程式 ▲ 、 ▲ 。