 某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是 ,含
,含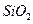 、
、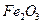 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: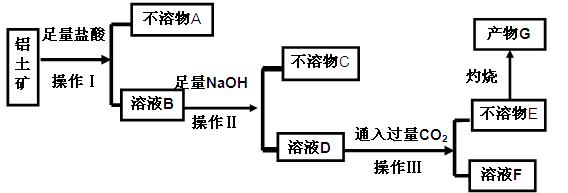

 请回答下列问题:
请回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
 某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是 ,含
,含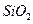 、
、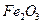 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下:

 请回答下列问题:
请回答下列问题: (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。