(12分,每空2分)在体积一定的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)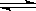 CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应正向为ΔH 0;若某一温度压强下,熵变ΔS<0,则该正向反应能否自发进行 (选填“能”或“不能”)
(2)能判断该反应达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃
其它条件不变,升高温度,容器内混合气体的密度 (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率 。

 铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀)
铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) O
O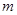 。
。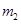 。
。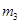 。
。 (碱式硫酸铁),该反应的化学方程式为。
(碱式硫酸铁),该反应的化学方程式为。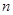 H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。
H2O),对FeSO4的制备(填“有”、“无”)影响,理由是(用离子方程式回答)。 NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验:
NO、SO、CO。将它们分别配成0.1 mol/L的溶液进行如下实验: 加Ba(NO3)2溶液无明
加Ba(NO3)2溶液无明
 ,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。
,其中氧化剂是, 8.4g铁粉参加反应,转移电子mol。 的方法是。
的方法是。 粤公网安备 44130202000953号
粤公网安备 44130202000953号