(原创题)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
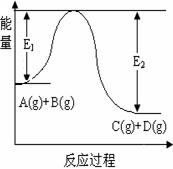
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________
(填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填“增大”“减小”“不变”)。
(4)已知下列热化学方程式:
①H2(g) +1/2O2(g)=H2O(l);ΔH="-285" kJ·mol-1
②H2(g) +1/2O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1
③C(s) +1/2O2(g)=CO(g);ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g);ΔH="-393.5" kJ·mol-1
回答下列问题:
①燃烧1gH2生成液态水,放出的热量为。
②写出CO燃烧热的热化学方程式。