盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生—系列转化,由下图判断下列关系错误的是 ( )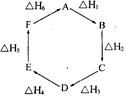
| A.A→F,△H=-△H6 |
| B.△H1+△H2+△H3+△H4+△H5+△H6=1 |
| C.C→F, |△H|=|△H1+△H2+△H6 | |
| D.|△H1+△H2+△H3|=|△H4+△H5+△H6 | |
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生—系列转化,由下图判断下列关系错误的是 ( )
| A.A→F,△H=-△H6 |
| B.△H1+△H2+△H3+△H4+△H5+△H6=1 |
| C.C→F, |△H|=|△H1+△H2+△H6 | |
| D.|△H1+△H2+△H3|=|△H4+△H5+△H6 | |