18.甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题:
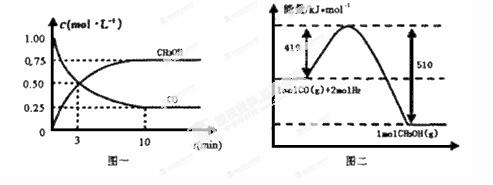
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____mol / (L·min)。
(2)写出该反应的热化学方程式_____________________________________________________
(3)恒容条件下,下列措施中能使 n(CO) /n(CH3OH)增大的有。
A.升高温度B.充入He气
C.再充入1 mol CO和2 mol H2D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器
|
反应物投入的量
|
反应物的转化率
|
CH3OH的浓度
|
能量变化(Q1、Q2、Q3均大于0)
|
甲
|
1 mol CO和2 mol H2
|
a1
|
c1
|
放出Q1kJ热量
|
乙
|
1mol CH3OH
|
a2
|
c2
|
吸收Q2kJ热量
|
丙
|
2mol CO和4 mol H2
|
a3
|
c3
|
放出Q3kJ热量
|
则下列关系正确的是:
A. c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1molCO、2mol H2和1mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向(填“正”、“逆”)反应方向移动,理由是由质量守恒,密度为原来的1.6倍,所以体积缩小,平衡正移。