某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】
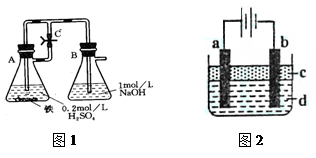
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水②NaCl溶液③NaOH溶液④四氯化碳⑤CuCl2溶液⑥乙醇⑦Fe棒⑧植物油⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】
实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
资料名称
|
物理性质描述
|
化学性质描述
|
《化学辞典》,顾翼东编,1989年版P637
|
白色无定形粉末或白色至淡绿色六方晶体
|
与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花
|
《大学普通化学(下册)》傅鹰著P637
|
白色沉淀
|
此沉淀易被氧化成微绿色Fe3(OH)8
|
《普通化学教程》(下册)P788
|
白色
|
能强烈吸收O2,迅速变成棕色
Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。
|
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。