回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4= Na+ + H+ + SO42- 。在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。
其中b点所示溶液呈 (填“酸性”、“中性”或“碱性”),c点所示的离子方程式为 。
(3)在t℃时,将NaHSO4晶体加入到pHH= 6的蒸馏水中,保持温度不变,测得溶液的pHH为2。t℃将 25℃(填“高于”或“低于”),Kw= ,在该溶液中由水电离出的c(H+)为 mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 = ,此溶液中各种离子的浓度由大到小的排列顺序为 。
(4)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为 。(用序号填空)
 物质
物质 N2+2CO2在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
N2+2CO2在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。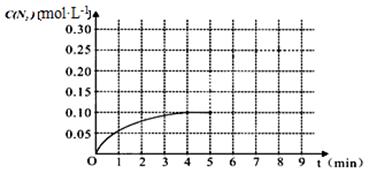

 O2(g) ="==" H2O(g)Δ H1= —242 kJ·mol-1
O2(g) ="==" H2O(g)Δ H1= —242 kJ·mol-1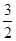 O2(g) ="==" CO2 (g) + 2 H2O(g)Δ H2= —676 kJ·mol-1
O2(g) ="==" CO2 (g) + 2 H2O(g)Δ H2= —676 kJ·mol-1

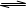 2SO3
2SO3
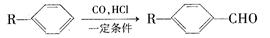
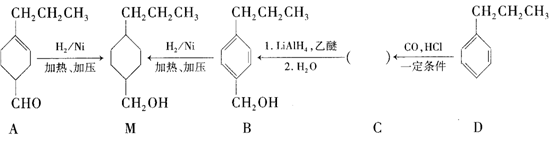
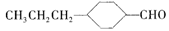 和______(写结构简式)生成。
和______(写结构简式)生成。 粤公网安备 44130202000953号
粤公网安备 44130202000953号