常温下,金属钠和氧气反应的产物(氧化钠)中总会混杂少量的过氧化钠。因此,生产中用金属钠制备氧化钠,采用以下反应:2NaNO2+6Na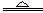 4Na2O +N2↑ 。
4Na2O +N2↑ 。
⑴上述反应的氧化剂是 ,氧化产物是 ;
 ⑵采用上述方法的主要原因是 。
⑵采用上述方法的主要原因是 。
常温下,金属钠和氧气反应的产物(氧化钠)中总会混杂少量的过氧化钠。因此,生产中用金属钠制备氧化钠,采用以下反应:2NaNO2+6Na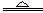 4Na2O +N2↑ 。
4Na2O +N2↑ 。
⑴上述反应的氧化剂是 ,氧化产物是 ;
 ⑵采用上述方法的主要原因是 。
⑵采用上述方法的主要原因是 。