恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a= 。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为 。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)= 。
(4)原混合气体中a : b= 。
(5)达到平衡时,N2和H2的转化率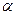 (N2):
(N2): 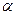 (H2)= 。
(H2)= 。
(6)平衡混合气体中n(N2): n(H2): n(NH3)= 。
 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol e-。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号