在容积相同的两密闭容器A和B中,保持温度为423K,同时向A和B中分别加入a mol和b mol HI气体(a>b),待反应2HI(g)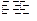 H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
A.从反应开始到建立平衡所需时间t(A)>t(B)
B. 平衡时HI的转化率(α)∶α(A)="α(B)"
C.平衡时I2蒸气在混合气体中的体积分数:A容器中>B容器中
D.平衡时A容器中I2的浓度c(I2)A等于B容器中I2的浓度c(I2)B
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A和B中分别加入a mol和b mol HI气体(a>b),待反应2HI(g)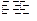 H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
H2(g)+I2(g)达到平衡,下列说法中肯定正确的是( )
A.从反应开始到建立平衡所需时间t(A)>t(B)
B. 平衡时HI的转化率(α)∶α(A)="α(B)"
C.平衡时I2蒸气在混合气体中的体积分数:A容器中>B容器中
D.平衡时A容器中I2的浓度c(I2)A等于B容器中I2的浓度c(I2)B