某芳香烃A有如下转化关系: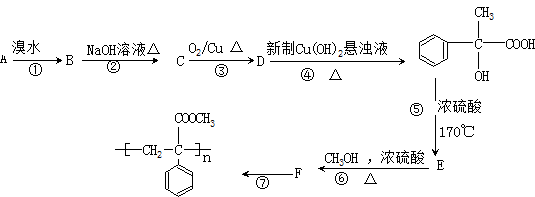
回答下列问题:
(1)写出反应类型:① ,⑥
(2)写出结构简式:A ,F
(3)下列有关F的描述正确的是( )
| A.属于芳香烃类化合物 | B.能发生取代反应 |
| C.能使溴水和KMnO4溶液褪色 | D.能发生加聚反应 |
(4)写出反应的化学方程式:⑦
某芳香烃A有如下转化关系:
回答下列问题:
(1)写出反应类型:① ,⑥
(2)写出结构简式:A ,F
(3)下列有关F的描述正确的是( )
| A.属于芳香烃类化合物 | B.能发生取代反应 |
| C.能使溴水和KMnO4溶液褪色 | D.能发生加聚反应 |
(4)写出反应的化学方程式:⑦