已知下热化学方程式:
①H2(g)+1/2O2(g)= H2O(l) ⊿H1= —285.8 kJ/mol
②H2(g)+1/2O2(g)= H2O(g) ⊿H2= —241.8kJ/mol
③C(s)+1/2O2 (g) =" CO" (g) ⊿H3= —110.5kJ/mol
④C(s)+ O2 (g) = CO2 (g) ⊿H4= —393.5kJ/mol
回答下列问题:
(1)比较⊿H1, ⊿H2,⊿H3, ⊿H4的大小
(2)上述反应中属于放热的是
(3)H2的燃烧热为 ,C的燃烧热为
(4)燃烧10g H2生成液态水,放出的热量为
(5)CO的燃烧热为 ,其热化学方程式为
(6)分别燃烧1mol C,H2,CO;充分燃烧后它们放出的热量分别为Q1,Q2,Q3
试比较Q1,Q2,Q3的大小
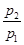 =0.64,则反应前混合气中丁烷的物质的量分数=。
=0.64,则反应前混合气中丁烷的物质的量分数=。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号