如图所示,在一熟苹果切片上分别滴上1滴碘水和1滴银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断中正确的是 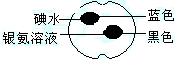
| A.熟透的苹果中含有脂肪 | B.熟透的苹果中不含淀粉 |
| C.熟透的苹果中含有还原性的糖 | D.熟透的苹果中不含还原性的糖 |
如图所示,在一熟苹果切片上分别滴上1滴碘水和1滴银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断中正确的是 
| A.熟透的苹果中含有脂肪 | B.熟透的苹果中不含淀粉 |
| C.熟透的苹果中含有还原性的糖 | D.熟透的苹果中不含还原性的糖 |