观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题: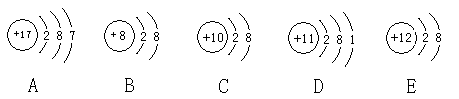
(1)属于离子结构示意图的是 、 (填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同) ,最容易失去电子的原子是 ,最容易得到电子的原子是 。
(3)A、B、D三种元素形成的一种化合物在水溶液中的电离方程式 。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号 、 。
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题: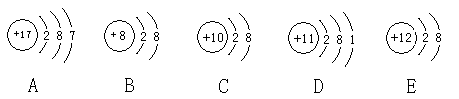
(1)属于离子结构示意图的是 、 (填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同) ,最容易失去电子的原子是 ,最容易得到电子的原子是 。
(3)A、B、D三种元素形成的一种化合物在水溶液中的电离方程式 。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号 、 。