(方程式每空2分,其余每空1分,共21分。)氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na + 2H2O =" 2NaOH" + H2↑
②2Na2O2 + 2H2O =" 4NaOH" + O2↑
③Na2O+ H2O ="2NaOH"
④3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
⑤2H2O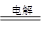 2H2↑+ O2↑
2H2↑+ O2↑
⑥2F2 + 2H2O =" 4HF" + O2
(1)其中不属于氧化还原反应的是(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是(填编号)
水只作还原剂的反应是(填编号)水既作氧化剂,又作还原剂是(填编号)
水既不作氧化剂,又不作还原剂是(填编号)
(3)根据你的理解,氧化还原反应的实质是()
| A.分子中的原子重新组合 |
B.氧元素的得失 |
| C.电子的得失或共用电子对的偏移 |
D.化合价的改变 |
(4)请你运用所学知识分析3NO2+H2O = 2HNO3+NO是否属于氧化还原反应?(填“是”或“不是”),若是,这个反应的氧化剂是,还原剂是。
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入足量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
②氯气与氢氧化钠溶液反应:
③铜片与稀硝酸的反应: