A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系:A在碱性条件下反应生成B、C,B、C在酸性条件下生成A。(部分产物及反应条件已略去):下列判断正确的是 ( )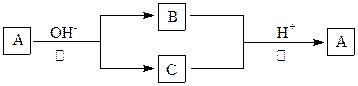
A.反应①和②一定为氧化还原反应 B.X元素不一定为非金属元素
C.反应①和②互为可逆反应 D.X元素可能为Al
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系:A在碱性条件下反应生成B、C,B、C在酸性条件下生成A。(部分产物及反应条件已略去):下列判断正确的是 ( )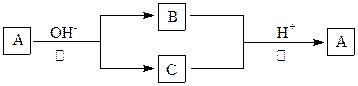
A.反应①和②一定为氧化还原反应 B.X元素不一定为非金属元素
C.反应①和②互为可逆反应 D.X元素可能为Al